W czasie ciąży, subtelna zmiana molekularna pozwala immunoglobulinom G (IgG), które stanowią najpowszechniejszy typ przeciwciał występujący w organizmie, na pełnienie skuteczniejszej roli ochronnej przed zakażeniami. Zdaniem naukowców, ten naturalny proces można odtworzyć, dzięki czemu możliwe będzie zwiększenie skuteczności szczepionek i innych terapii opartych na działaniu przeciwciał.
Już wiele lat temu naukowcy odkryli, że odporność noworodków w walce z patogenami opiera się przede wszystkim na działaniu aktywnych składników immunologicznych pochodzących od matki. Wraz z dorastaniem, dzieci kształtują swój układ immunologiczny w trakcie naturalnej ekspozycji na wirusy i bakterie występujące w otoczeniu oraz przez sztuczną immunizację antygenami zawartymi w szczepionkach. Jednak do tego czasu, jednym z najważniejszych ochronnych „podarunków” jakie matka przekazuje swojemu dziecku w tym najbardziej wrażliwym okresie życia – są przeciwciała.
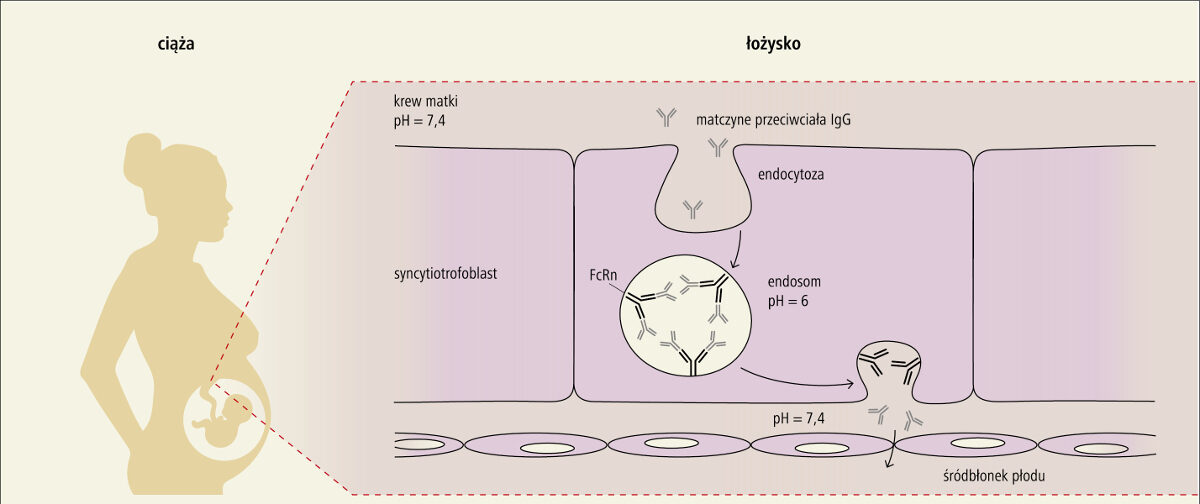
Mechanizmy transferu przeciwciał przez łożysko
Krążące przeciwciała IgG są wchłaniane do komórek syncytiotrofoblastu, gdzie dwie cząsteczki IgG wiążą się poprzez receptor FcRn z błoną wewnętrzną endosomów w środowisku o odczynie kwaśnym. Po otwarciu endosomu przy podstawno bocznej powierzchni komórki od strony naczyń krwionośnych płodu, FcRn uwalnia cząsteczki IgG na skutek zwiększonego pH, a następnie ulega recyrkulacji i proces transportu immunoglobulin powtarza się.
Albrecht M. and Arck P.C. (2020), Vertically transferred immunity in neonates: mothers, mechanisms and mediators. Frontiers in Immunology, 11: 555. doi: 10.3389/fimmu.2020.00555. tłum. lek. Iwona Rywczak, Medycyna Praktyczna
Poznanie mechanizmów stojących za ochroną immunologiczną opartą na przeciwciałach matczynych stanowiło podstawowy przedmiot badań w neonatologii. Dotychczas uważano, że przeciwciała „celują” jedynie w patogeny obecne poza komórkami ciała, jednak wiele mikroorganizmów, m. in. paciorkowce z grupy B (GBS), Escherichia coli, Listeria monocytogenes czy wirus Epstein-Barr (EBV), namnażają się i są w stanie przetrwać we wnętrzu komórek. Czy przeciwciała matczyne są w stanie ochronić niemowlę przed zakażeniem wewnątrzkomórkowym i zapobiec dalszemu rozwojowi choroby?
Wyniki szeroko zakrojonych badań opublikowane 8 czerwca 2022 roku w magazynie Nature dostarczają nowych informacji w temacie funkcjonowania matczynych mechanizmów ochronnych obecnych u noworodków i niemowląt. Autorzy artykułu zastanawiają się też jakie konsekwencje w prewencji wielu chorób zakaźnych i związanych z nimi powikłań, mogą mieć pozyskane przez nich dane. Dzięki tym odkryciom badacze będą mogli odwzorować strukturę superprzeciwciał powstających w czasie ciąży, co umożliwi opracowanie nowych leków i ulepszenie szczepionek wspomagających terapie i zapobiegających wielu chorobom.
Molly Campbell, Technology Networks (MC): Czy możesz przedstawić przesłanki jakie przyświecały twórcom badania, biorąc pod uwagę dotychczasową wiedzę na temat przeciwciał matczynych?
John Erickson (JE): „Od dawna wiemy, że matka przekazuje przeciwciała dziecku zarówno w czasie ciąży, jak i po narodzinach, wraz z pokarmem kobiecym – jest to tzw. odporność bierna swoista. Dzięki niej noworodek zyskuje podstawową ochronę w okresie swojej największej podatności na infekcje. Rzeczywiście, około 50% śmiertelności wśród dzieci poniżej 5 lat dotyczy noworodków do 28. dnia życia, a duża część z tych 2,5 miliona zgonów w ciągu roku jest skutkiem zakażeń prowadzących do sepsy, zapalenia płuc czy biegunki.
Jednym z ograniczeń w działaniu przeciwciał jest ich główne ukierunkowanie na drobnoustroje pozakomórkowe, podczas gdy wiele wirusów i bakterii przyczyniających się do poważnych zakażeń przechodzi swój cykl życiowy wewnątrz komórek, czyli w miejscu do którego przeciwciała mają ograniczony dostęp. Stąd też naukowcy poszukują wyjaśnienia tej kluczowej dla immunologii kwestii – czy matka jest w stanie ochronić swoje dziecka również przed inwazją wewnątrzkomórkowych mikroorganizmów?
W naszych badaniach wykorzystaliśmy wewnątrzkomórkowo żyjącą bakterię Listerię monocytogenes, czynnik etiologiczny listeriozy; u ciężarnych i niemowląt choroba ta stanowi poważne zagrożenie. Chcieliśmy ustalić czy przeciwciała matczyne są w stanie ochronić noworodka przed zakażeniem. Byliśmy zafascynowani wynikami – okazało się, że immunoglobuliny swoiste dla L. monocytogenes pochodzące od ciężarnych myszy zabezpieczają mysie oseski przed infekcją. Przeciwciała rzeczywiście mają „moc” hamującą zakażenie toczące się wewnątrz komórek; ale doszliśmy do tego dopiero gdy włączyliśmy aspekt ciąży do badań nad immunologią. W poprzednich doświadczeniach z L. monocytogenes skupiono się przede wszystkim na dorosłych osobnikach, przeniesienie badań w obszar związany z fizjologią rozmnażania przyspieszyło nasze odkrycia. Ma to ważne implikacje na przyszłość np. dla opracowania skuteczniejszych metod zmniejszających śmiertelności u noworodków.”
„Przez długi czas naukowcy uważali, że przeciwciała nie mogą wnikać do wnętrza komórek, ze względu na brak odpowiednich mechanizmów. Dlatego też infekcje wywołane przez patogeny żyjące wyłącznie wewnątrz komórek traktowano jako „niewidzialne” w terapii opartych na przeciwciałach.”
— dr Sing Sing Way z Oddziału Chorób Zakaźnych w Cincinnati Children’s
MC: Z waszego badania wynika, że ciąża wpływa na zmiany w strukturze cukrów przyłączonych do immunoglobulin. Możesz wyjaśnić w jaki sposób te zmiany strukturalne wzmacniają ochronny efekt matczynych przeciwciał?
JE: „Modyfikacje jakie zachodzą w cząsteczkach są niezwykle subtelne. Drogą eliminacji udało nam się wytypować molekularny przełącznik odpowiedzialny za ten efekt. W pierwszej kolejności wykluczyliśmy standardową zmienność jaką można zaobserwować w budowie przeciwciał tj. różnice izotypowe czy swoistość wiązania (z antygenem). Dalej doszliśmy do wniosku, że zmiana ta ma charakter potranslacyjny, czyli powstaje już po wytworzeniu się przeciwciała. Wynikało to z faktu, że ciężarne myszy były w stanie przekształcić istniejące już wcześniej przeciwciała w nową, zmienioną formę.
Najczęstsza modyfikacja dotyczyła łańcuchów cukrowych przyłączanych do immunoglobulin – proces ten nazywamy glikozylacją. Na pierwszy rzut oka wzór strukturalny cukru zarówno u myszy ciężarnych jak i „dziewiczych” wyglądał identycznie. Uderzyła nas jednak niezwykle wysoka ilość kwasu sjalowego (jego obecność wiąże się głównie z ostatnim etapem procesu glikozylacji). Pozbawiliśmy przeciwciała ciężarnych myszy kwasu sjalowego i zauważyliśmy, że ich zdolność do zwalczania Listerii całkowicie zanikła. Następnie za pomocą „glikoinżynierii” usunęliśmy kwas sjalowy z przeciwciał myszy „dziewiczych” i dodaliśmy jego standardową formę, co zaowocowało efektem ochronnym u mysich noworodków. Wysunęliśmy wniosek, że w takim razie musi istnieć „dziewiczy wariant” kwasu sjalowego, który uniemożliwia przeciwciałom hamowanie rozwoju zakażenia L. monocytogenes.
Te subtelne modyfikacje dotyczyły acetylacji kwasu sjalowego. W czasie ciąży mamy do czynienia z podwyższonym poziomem enzymu zwanego SIAE (acetyloesteraza kwasu sjalowego), który katalizuje reakcję chemiczną odwracającą acetylację. Acetylacja to bardzo niewielka zmiana – to dodanie tylko 6 atomów! Jednak to wystarczy aby receptory obecne na limfocytach B (receptory CD22) nie rozpoznały przeciwciała w takiej formie. Działa to jak włącznik w niektórych subpopulacjach limfocytów B, szczególnie w tych wydzielających duże ilości interleukiny 10 (IL-10) – czynnika hamującego produkcję cytokin prozapalnych. Uruchamia się kaskada reakcji.
Przeciwciała pochodzące od „dziewiczych” myszy posiadające acetylowaną wersję kwasu sjalowego nie są w stanie związać się z receptorem CD22 na limfocytach B, w związku z czym nie mogą ich „wyłączać”. Interleukina 10 (IL-10) jest cytokiną przeciwzapalną, hamuje działanie innych komórek odpornościowych, w efekcie czego podatność na infekcje wzrasta u noworodków. Przeciwciała ciężarnych myszy, które zostały pozbawione acetylowanej formy kwasu sjalowego zachowują zdolność przyłączenia do receptora CD22 i hamują produkcję IL-10 w limfocytach B, dzięki czemu ryzyko rozwoju zakażenia zmniejsza się.”
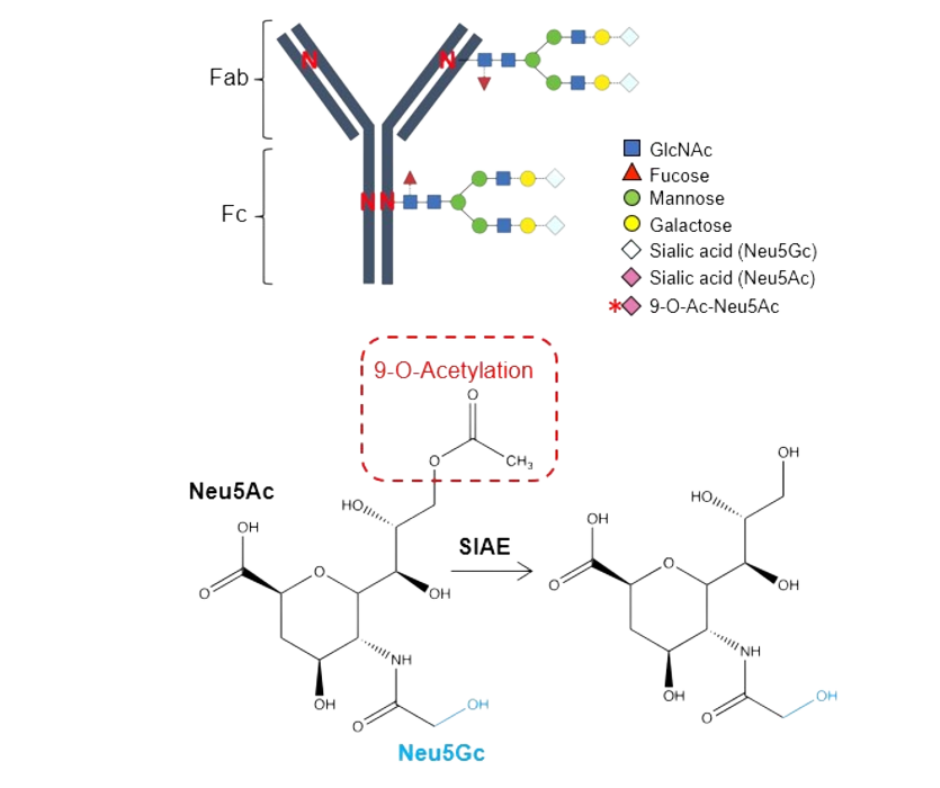
Wytwarzanie superprzeciwciał
W czasie ciąży przeciwciała zmieniają swoją strukturę na bardziej ochronną – zachodzi deacetylacja czyli odłączenie grup acetylowych reszt kwasu sjalowego, w wyniku czego uwidaczniają się naturalne ligandy dla receptorów regulatorowych, poszerzając w ten sposób zakres ochronny przeciwciał.
Erickson, J.J., Archer-Hartmann, S., Yarawsky, A.E. et al. Pregnancy enables antibody protection against intracellular infection. Nature, 2022
MC: Czy możesz omówić zaawansowane techniki spektometrii mas i inne metody, dzięki którym udało Wam się wykazać różnice biochemiczne między przeciwciałami?
JE: „W pierwszej kolejności wykorzystaliśmy lektyny (glikoproteiny o właściwościach wiążących cukier) pozyskane od pewnego gatunku kraba pacyficznego oraz z wirusa wywołującego infekcje u świń, ze względu na ich znaną zdolność wiązania się z acetylowaną wersją kwasu sjalowego. Zastosowanie tych lektyn potwierdziło nasze wcześniejsze podejrzenia, że przeciwciała „dziewiczych” myszy zawierają większą ilość acetylowanego kwasu sjalowego.
Później skontaktowaliśmy się z naszymi współpracownikami z University of Georgia Complex Carbohydrate Research Center; są oni bardziej doświadczeni w pracy z zaawansowanymi technikami spektometrii mas. Dzięki ich wysiłkom udało się ostatecznie potwierdzić, że przeciwciała „dziewiczych” myszy zawierały około 10 razy więcej acetylowanego kwasu sjalowego w porównaniu z przeciwciałami ciężarnych gryzoni.”
MC: Jakie podejście przyjęliście w tym badaniu?
JE: „Idea jaka nam przyświecała skupiała się na zgłębieniu immunologii z uwzględnieniem wpływu ciąży, kiedy to układ immunologiczny matki i dziecka są ze sobą ściśle powiązane. Dzięki takiemu podejściu mogliśmy wykryć bardzo subtelne lecz niezwykle ważne zmiany, dzięki którym noworodki mogą być chronione przed infekcjami.
W momencie gdy udało się wykazać, że potomstwo nabywa matczyną odporność przed szczególnie zjadliwymi patogenami, które – jak sądzono dotychczas – umykają odpowiedzi ze strony przeciwciał, wykorzystaliśmy myszy modyfikowane genetycznie aby sprawdzić, jaka dokładnie frakcja układu odpornościowego odpowiada za ten mechanizm.
Okazało się, że przeciwciała działają w trochę inny sposób, który nauka uważała przez długi czas za niemożliwy. Nasza współpraca badawcza i zastosowane techniki immuno- i biochemiczne przyczyniły się do skonstruowania wniosków, że w strukturze cukrów przyłączanych do przeciwciał zachodzi niewielka, molekularna zmiana. Właściwie, można powiedzieć, że naprawdę „mamy wiedzą lepiej” – nawet w kwestii ochrony swoich pociech super-przeciwciałami.”
Między kobietą i jej potomstwem istnieje wyjątkowy, intymny związek; możemy tutaj mówić o diadzie – matka-dziecko. Ta szczególna relacja rozpoczyna się w środowisku wewnątrzmacicznym i trwa dalej po narodzinach.
— dr n. med. John Erickson
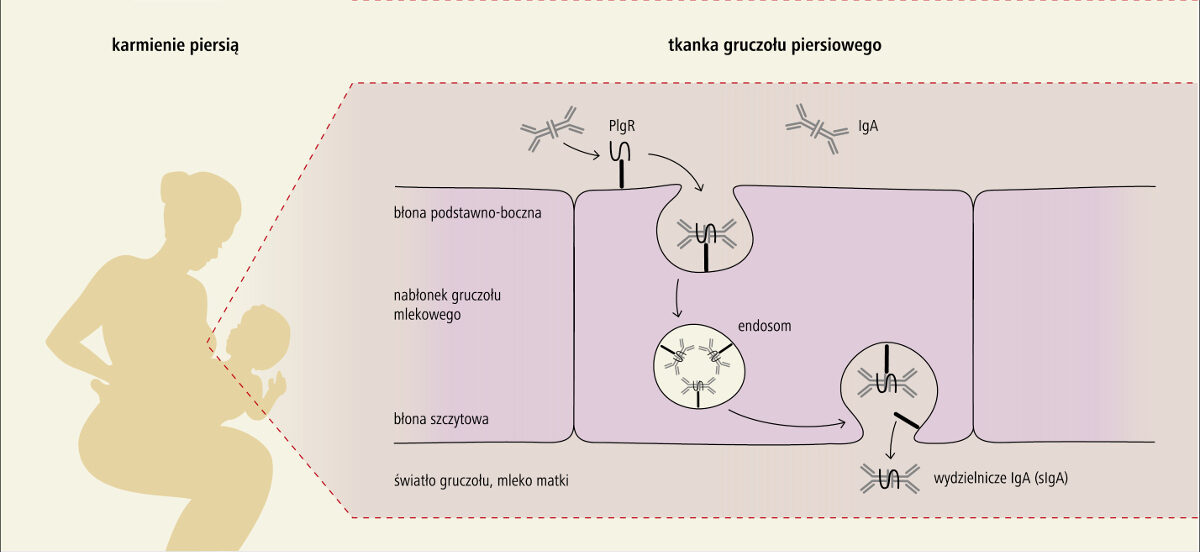
Mechanizmy transferu przeciwciał przez tkanki gruczołu mlekowego.
Łańcuch łączący dimeru IgA wiąże się z receptorem dla polimerycznych immunoglobulin (PIgR), a następnie razem z pIgR ulega internalizacji na drodze endocytozy. W błonie szczytowej wydzielnicze IgA (sIgA) są wydzielane do mleka, wydzielnicza część pIgR pozostaje związana z przeciwciałami IgA.
Albrecht M. and Arck P.C. (2020), Vertically transferred immunity in neonates: mothers, mechanisms and mediators. Frontiers in Immunology, 11: 555. doi: 10.3389/fimmu.2020.00555. tłum. lek. Iwona Rywczak, Medycyna Praktyczna
MC: Z waszej pracy wynika, że acetylowana forma kwasu sjalowego u ciężarnych ulega deacetylacji. Czy kwas sjalowy występuje zazwyczaj w tej pierwszej wersji, i dlaczego ta zmiana zachodzi akurat w okresie ciąży?
JE: „Ilość kwasu sjalowego, jaka ulega acetylacji jest różna w zależności od rodzaju tkanki; ogólnie mówiąc acetylacja tej cząsteczki zachodzi stosunkowo rzadko, stanowi kilka procent całkowitej puli kwasu sjalowego. Zanim rozpoczęliśmy nasz projekt nie mieliśmy świadomości, że ta reakcja dotyczy również przeciwciał. Jest to najbardziej uderzające w naszej pracy.
Znalezienie odpowiedzi na pytanie w jaki sposób zakażenie Listerią indukuje produkcje przeciwciał z acetylowanym kwasem sjalowym stanie się przedmiotem przyszłych badań. Sądzimy, że w czasie ciąży wzrasta poziom enzymu odpowiedzialnego za odwracanie reakcji acetylacji, dzięki czemu przeciwciała z większą zdolnością ochronną mają szansę wspomóc odporność niemowląt. Być może to jeden ze sposobów natury na ulepszenie „zdolności reprodukcyjnych”.
MC: Powiedziałeś, że „zmiany molekularne w cząsteczkach przeciwciał jakie naturalnie zachodzą w czasie ciąży można odtworzyć w taki sposób aby układ odpornościowy był odpowiednio pobudzany.” Rozwiniesz tę myśl?
JE: „Społeczność naukowa i przemysł farmaceutyczny osiągnęły biegłość w produkcji przeciwciał przeznaczonych do różnych celów, również w leczeniu takich schorzeń jak nowotwory, choroby autoimmunologiczne czy zakażenia.
Jednak biorąc pod uwagę nasze dane trafiliśmy właśnie na niewykorzystany jak dotąd potencjał: manipulowania działaniem przeciwciał za pomocą glikozylacji – wystarczy przyłączyć odpowiedni rodzaj cukru do cząsteczki immunoglobuliny. Nasze odkrycia unaoczniają nam, że potrzebna jest niewielka ingerencja, która wpłynie w znacznym stopniu na ich funkcje.”
MC: Wasze badanie prowadziliście przede wszystkim na modelach zwierzęcych. Jak uzyskane przez Was wyniki przekładają się na ludzi?
JE: „Zgadza się, większość naszej pracy przebiegała w laboratorium z wykorzystaniem myszy. Dzięki temu mieliśmy możliwość wprowadzać modyfikacje i manipulować glikobiologią pod kątem zakażeń wewnątrzkomórkowych i odpowiedzi swoistej ze strony przeciwciał.
Nie ukrywam, że niezbędne są dalsze eksperymenty ze zwierzętami, w których chcielibyśmy jeszcze dokładniej przyjrzeć się mechanizmom powstawania i działania superprzeciwciał. Co istotne, w naszym artykule zaznaczyliśmy, że kluczowy enzym regulujący acetylację (SIAE) w czasie ciąży występuje w większej ilości zarówno w mysich, jak i ludzkich komórkach odpornościowych. Bardzo ważne będzie potwierdzenie tych wyników w odniesieniu do ludzi – powinniśmy sprawdzić, czy przeciwciała u ciężarnych kobiet też posiadają acetylowaną wersję kwasu sjalowego i czy zmniejsza się ona w czasie ciąży.”
MC: Czy pojawiły się jakieś ograniczenia w badaniu, o których chciałbyś wspomnieć?
JE: „Przez dziesięciolecia immunolodzy uważali, że rola przeciwciał w obronie przed patogenami wewnątrzkomórkowymi jest mocno ograniczona. Takie wnioski pojawiły się we wcześniejszych badaniach, w których zaobserwowano potencjał ochronny wszczepionych komórek odpornościowych, z kolei podanie myszom surowicy zawierającej swoiste immunoglobuliny przeciwko Listerii nie chroniło zwierząt przed zakażeniem. Nasza praca łącząca immunologię z fizjologią reprodukcji postawiła dotychczasowy koncept na głowie. Dalsze badania pozwolą odpowiedzieć na pytanie czy takie zjawisko zachodzi w przypadku innych infekcji wewnątrzkomórkowych.”
Aby dziecko zyskało odporność od matki, musi ona wpierw ją posiąść. Bez naturalnej ekspozycji lub odporności nabytej w wyniku szczepienia, w okresie ciąży kiedy organizm ma możliwość „przełączyć” przeciwciała, mechanizm nie zadziała.
— dr Sing Sing Way
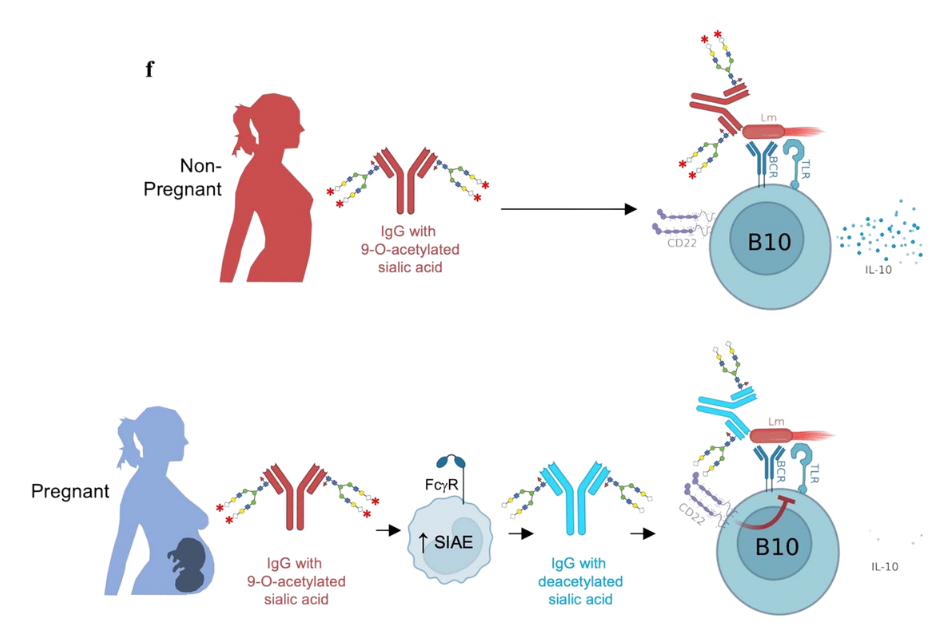
(f) Indukowane ciążą „deacetylowane” przeciwciała skierowane przeciwko L. monocytogenes ujawniają swój ochronny potencjał przyłączając się do komórek limfocytów B (za pomocą receptora CD22) i hamując wydzielanie przeciwzapalnej interleukiny 10 (IL-10).
Erickson, J.J., Archer-Hartmann, S., Yarawsky, A.E. et al. Pregnancy enables antibody protection against intracellular infection. Nature, 2022
Do tej pory w ramach testów wyprodukowano setki przeciwciał monoklonalnych mających potencjał w leczeniu różnych schorzeń, w tym nowotworów, astmy, stwardnienia rozsianego i ciężkich infekcji wirusowych i bakteryjnych, w tym również COVID-19. Niektóre z nich zostały już zatwierdzone przez FDA, inne przechodzą fazę badań klinicznych, a w części nie uzyskano zadawalających wyników.
- Erickson, J.J., Archer-Hartmann, S., Yarawsky, A.E. et al. Pregnancy enables antibody protection against intracellular infection. Nature, 2022 DOI: 10.1038/s41586-022-04816-9
- Cincinnati Children’s Hospital Medical Center. (2022, June 8). Pregnant women produce super antibodies to protect newborns, now scientists know how. ScienceDaily.
- Molly Campbell, (June 8, 2022). “Subtle Change” in Mothers’ Antibodies During Pregnancy Protects Newborns. Technology Networks
Podobne artykuły:

Do tej pory rozwój układu odpornościowego u płodu stanowił pewną zagadkę, jednak niedawno opublikowane wyniki sugerują, że komórki dendrytyczne pojawiają się w organizmie wcześnie, już w drugim trymestrze ciąży, a jednym z ich zadań jest hamowanie reakcji immunologicznej na komórki matczyne.
Odpowiedź immunologiczna zależy od płci
Układ odpornościowy mężczyzny i kobiety reaguje odmiennie na zakażenie. Badania przedstawione w ubiegłym tygodniu na spotkaniu mikrobiologów w Bostonie sugerują, że różnice te mogą wpłynąć na opracowanie np. programów szczepień czy bardziej ukierunkowanych terapii.

Wiedza na temat ochronnych właściwości mleka kobiecego jest znana już od dawna; jednym z mechanizmów odpowiedzialnych za taki efekt jest transfer przeciwciał, wpływający na tzw. “odporność bierną”. Zespół naukowców z University of California z Riverside udowodnił, że oprócz tego, mleko ma również duży wpływ na tworzenie układu odpornościowego dziecka przez proces, który nazwano “matczyną edukacją odporności”.
Pingback: Przeciwciała obecne w mleku kobiecym wpływają na mikrobiotę jelitową i odporność niemowląt
Pingback: Życie blisko zieleni ma wpływ na zawartość oligosacharydów w mleku matki » mammalium.pl