Początkowe etapy rozwoju embrionalnego kryją wiele tajemnic życia. Ich poznanie może pomóc nam lepiej zrozumieć wczesny rozwój organizmu i występowanie wad wrodzonych, a także opracowanie nowych metod leczenia medycyną regeneracyjną. Badacze z Instytutu Medycyny Regeneracyjnej (ARMI) na Monash University w Australii zbadali krytyczny moment w rozwoju embrionalnym ssaków, korzystając z potężnych i innowacyjnych technik obrazowania. Ich praca została opublikowana w czasopiśmie Nature Communications.
To musi być przeznaczenie
„Zaledwie w kilka dni po rozpoczęciu embriogenezy, przekształcając się w 16 komórkową blastocystę, zarodek musi podjąć swoją pierwszą trudną decyzję – które z jego komórek dadzą początek ciała, a które staną się tkanką poza zarodkową, na przykład łożyskiem” – wyjaśnia dr Jennifer Zenker, główna badaczka.
W ramach projektu zespół naukowców odkrył, w jaki sposób ten proces podejmowania decyzji jest ułatwiany, poprzez uchwycenie wewnętrznej organizacji pojedynczych komórek wczesnego embrionu.
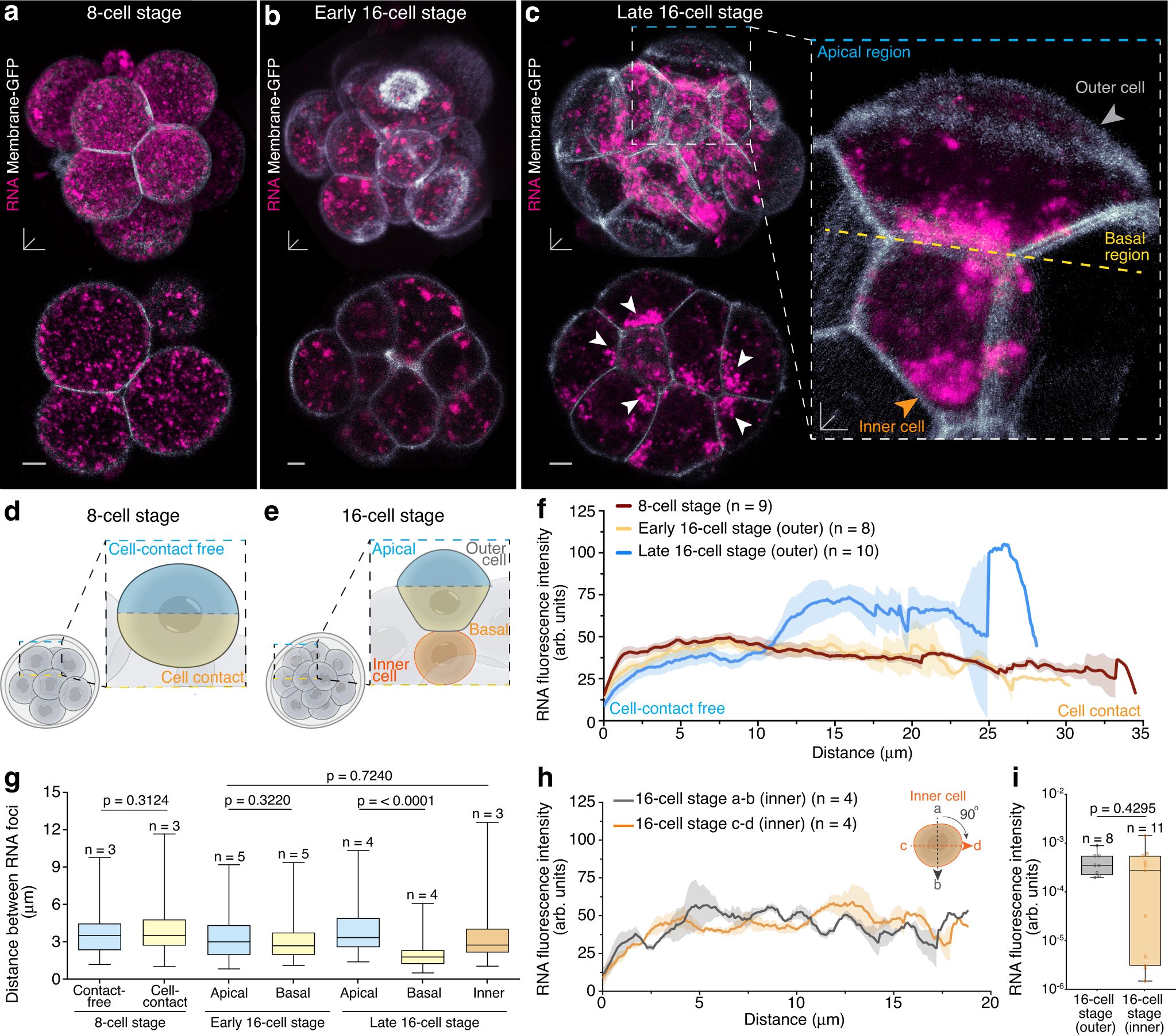
a| 8-komórkowe stadium zarodka
b| wczesne 16-komórkowe stadium zarodka
c| późne 16-komórkowe stadium zarodka z asymetrycznie rozlokowanym RNA (większa kumulacja w regionie bazalnym – zaznaczone białymi strzałkami i żółtą przerywaną linią)
„Kluczową rolę odgrywa tutaj kwas rybonukleinowy, RNA. W fazie 16-komórkowego zarodka, różne podtypy RNA (rRNA, mRNA i tRNA), są sortowane do dwóch krańców komórki, nazywanych stroną apikalną (szczytową) i bazalną (podstawną). Rozmieszczenie podtypów RNA determinuje dalsze losy kolejnych pokoleń komórek embrionu decydując o tym w co się przekształcą następne generacje” – mówi dr Zenker.
Co ciekawe, podczas gdy większość mRNA i tRNA gromadzi się po stronie apikalnej, rRNA przechodzi na stronę bazalną, wykorzystując do tego organelle zwane lizosomami oraz mikrotubule. Pomimo mniejszej ilości całkowitego RNA, apikalne strony komórek zewnętrznych w fazie 16-komórkowej zarodka zawierają pełny zestaw RNA oraz innych czynników niezbędnych do produkcji białek.
Strona bazalna jest jednak głównie zajęte przez rRNA. Komórki potomne, posiadające bardziej aktywne fabryki tworzenia białek na stronie apikalnej, są bardziej podatne na transformację i rozwijają się w kierunku przyszłego łożyska. Z kolei komórki, które zachowały swoją zdolność do przekształcenia się w dowolny rodzaj tkanki organizmu (pluripotencja), otrzymują mniej aktywną translacyjnie frakcję rRNA.
Opisany mechanizm i wiele podobnych procesów determinujących los komórki są ważne w trakcie rozwoju ponieważ określają sposób w jaki osiągną one swój ostateczny kształt, np. komórki skóry, mięśnia sercowego czy mózgu. W przypadku medycyny regeneracyjnej, możliwość kierowania przeznaczeniem komórek pozwoli opracować nowe metody terapii oparte na komórkach macierzystych.
„Podobnie jak w życiu, komórki zarodka mogą wpływać na kierunek swojej własnej przyszłości, organizując się na bardzo wczesnym etapie. Nasze badania mogą przyczynić się do lepszego przewidywania i kierowania decyzjami dotyczącymi przeznaczenia komórek” – mówi dr Zenker.
- Hawdon, A., Geoghegan, N.D., Mohenska, M. et al. Apicobasal RNA asymmetries regulate cell fate in the early mouse embryo. Nat Commun 14, 2909 (2023). https://doi.org/10.1038/s41467-023-38436-2
- Monash University. „Scientists unveil RNA-guided mechanisms driving cell fate.”
Zarodek za kierownicą
Autorzy badania (IMBA) Nicolas Rivron, Jinwoo Seong i Viktoria Holzmann opowiadają o swoich odkryciach. ©IMBA 2022.
Często uważa się embrion za „coś” niezwykle delikatnego i potrzebującego wsparcia. Jednak już na początkowym etapie rozwoju zarodek potrafi odżywiać przyszłe łożysko, przekazuje też instrukcje macicy, aby ta mogła przygotować się do zagnieżdżenia. Korzystając z blastoidów (modeli embrionów utworzonych z komórek macierzystych) Laboratorium Nicolasa Rivrona w IMBA wykazało, że najwcześniejsze sygnały molekularne, które indukują rozwój łożyska i przygotowują macicę, pochodzą od samego embrionu. Wyniki te, opublikowane w Cell Stem Cell, mogą przyczynić się do lepszego zrozumienia płodności u ludzi.
Kto opiekuje się kim na początku życia?
Doskonale zdajemy sobie sprawę, że to łożysko i macica odżywiają i chronią płód. Jednak na tak wczesnym etapie rozwoju, gdy jeszcze „zawieszona” w macicy blastocysta szykuje się do wniknięcia w endometrium, nie wszystko jest jasne. Grupa badawcza Nicolasa Rivrona w IMBA (Instytut Biotechnologii Molekularnej Austriackiej Akademii Nauk) odkryła fundamentalne zasady wczesnego rozwoju, wykorzystując blastoidy.
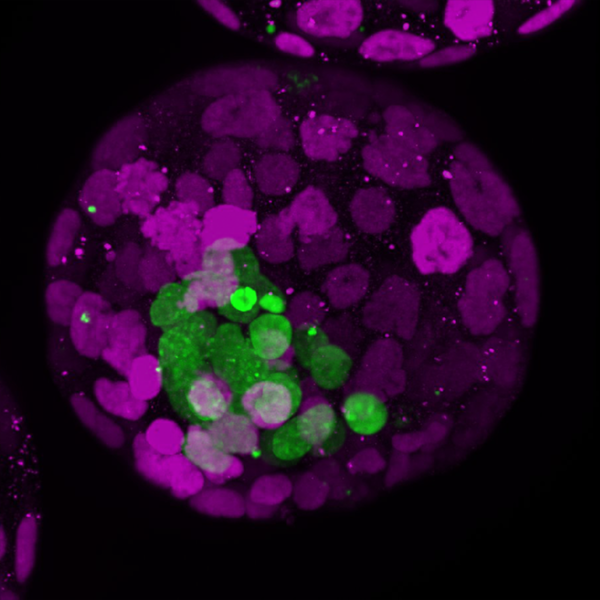
Mysi blastoid wybarwiony fluorescencyjnie, ukazane różne składniki komórkowe. | © Rivron/CellStemCell/IMBA.
Blastoidy to modele in vitro blastocysty, zarodka ssaka w pierwszych dniach po zapłodnieniu. Modele tych embrionów zostały po raz pierwszy opracowane przez laboratorium Rivrona z wykorzystaniem komórek macierzystych myszy (Nature, 2018), a następnie z komórek ludzkich (Nature, 2021). Blastoidy stanowią etyczną alternatywę dla wykorzystywania embrionów w badaniach i, co ważne, umożliwiają wiele odkryć.
Eksperymenty z blastoidami rozstrzygnęły dylemat „jajka i kury”. Korzystając z mysich blastoidów naukowcy odkryli, że wczesna część embrionalna zarodka (~10 komórek) instruuje przyszłą część łożyska (~100 komórek) do tworzenia i zmiany w tkankach macicy. „Działając w ten sposób embrion inwestuje w swoją własną przyszłość: promuje tworzenie tkanek, które wkrótce będą odpowiedzialne za jego rozwój. Embrion kontroluje cały proces niejako stwarzając dla siebie wspierające środowisko” – oświadcza Nicolas Rivron.
Zespół odkrył kilka cząsteczek wydzielanych przez nieliczne komórki, z których rozwija się płód, tzw. epiblasty. Zaobserwowano, że cząsteczki te informują inne komórki – trofoblasty, które później tworzą łożysko, do odnowy i namnażania.
Zaobserwowano również, że odkryte cząsteczki stymulują trofoblasty do wydzielania dwóch innych cząsteczek – WNT6 i WNT7B. WNT6 i WNT7B informują komórki macicy, aby „owijały się” wokół blastocysty. „Już wcześniej zauważono, że cząsteczki WNT są zaangażowane w reakcję tkanek macicy. Udało nam się potwierdzić, że za tymi sygnałami stoją WNT6/7B i że są one produkowane przez komórki trofoblastu blastocysty. To odkrycie ma duże znaczenie, ponieważ, jak zweryfikowaliśmy, te dwie cząsteczki są również wydzielane u ludzi” – mówi Nicolas Rivron.
Mysi blastoid wybarwiony fluorescencyjnie, ukazane różne składniki komórkowe.|©Rivron/CellStemCell/IMBA.
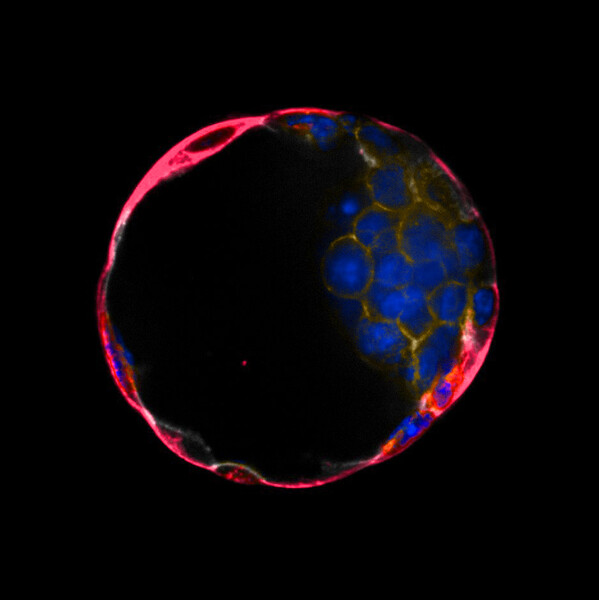
Zespół dokonał częściowo swoich odkryć, badając stopień implantacji blastoidów myszy w mysim modelu implantacji. „Byłem bardzo zaskoczony efektywnością, z jaką nasze blastoidy zagnieżdżały się w macicy. Zmieniając właściwości trofoblastów w blastoidach, w tym poziomy wydzielania WNT6/7B, wyraźnie mogliśmy zmienić rozmiar macicy” – mówi autor badania Jinwoo Seong, doktorant w laboratorium Rivrona, który przeprowadził eksperymenty.
Ponieważ implantacja jest najważniejszym etapem ciąży u ludzi – około 50% ciąż kończy się niepowodzeniem w tym czasie – a WNT6 i WNT7B są obecne również w blastocystach ludzkich, te wyniki mogą wyjaśnić, dlaczego czasami dochodzi do nieprawidłowości. „Obecnie powtarzamy te eksperymenty z blastoidami ludzkimi i komórkami macicy, wszystko w warunkach laboratoryjnych na szalkach, aby oszacować zachowanie takich podstawowych zasad w procesie rozwoju. Te odkrycia mogą w rezultacie przyczynić się do poprawy procedur zapłodnienia in vitro, opracowania leków na płodność i środków antykoncepcyjnych” – mówi Nicolas Rivron.
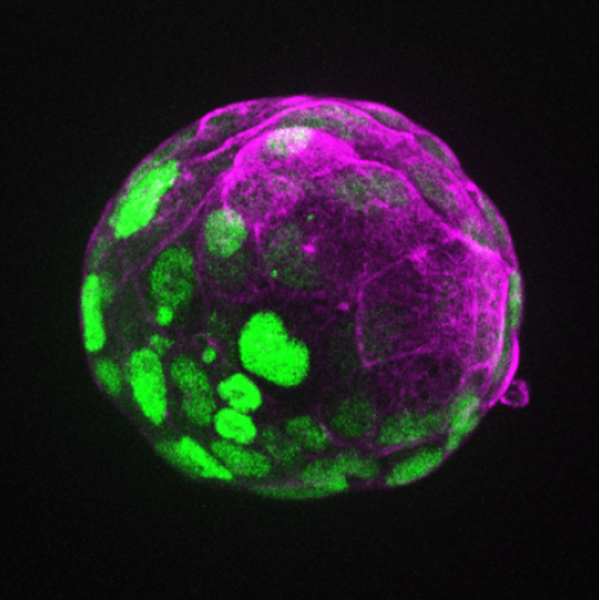
Ekspresja genów kodujących białka w komórkach w mysim blastoidzie. | © Rivron/CellStemCell/IMBA.
„Zrozumienie tych fundamentalnych zasad rozwoju embrionalnego w rezultacie przyczyni się do wsparcia kobiet w kontroli nad swoją płodnością, co poprawi nie tylko planowanie rodziny, ale również wpłynie na równość płci w społeczeństwie” – mówi Viktoria Holzmann.
- Seong J, Frias-Aldeguer J, Holzmann V, et al. „Epiblast inducers capture Trophectoderm Stem Cells in vitro and pattern blastoids for implantation in utero”, 2022 Cell Stem Cell. DOI: https://doi.org/10.1016/j.stem.2022.06.002
- IMBA- Institute of Molecular Biotechnology of the Austrian Academy of Sciences. „The beginning of life: The early embryo is in the driver’s seat.„